Общие сведения: что такое рак?
Рак — это злокачественное образование, состоящее из мутировавших клеток, которые быстро делятся и растут, затрагивая соседние ткани. В какой-то момент опухоль начинает распространять метастазы по всему организму.
Опухоли могут развиваться из различных клеток человеческого тела: кожи, костей, мышц и нервных волокон. Поэтому они могут возникать в самых разных частях тела. Чем больше информации врачи имеют о локализации опухоли и её клеточной структуре, тем выше вероятность успешного лечения. Это позволяет специалистам разработать наиболее эффективный план терапии. Однако до сих пор неясно, почему одни опухоли приводят к быстрой смерти пациента, другие хорошо поддаются лечению, а третьи могут появиться снова спустя несколько лет.
Раковая опухоль не поддаётся контролю со стороны организма. Клетки опухоли имеют собственное ДНК и могут маскироваться, что позволяет им избегать распознавания иммунной системой.
Существуют различные методы лечения раковых опухолей:
- Операция. Основная цель — удалить первичный очаг опухоли и метастазы, а также устранить осложнения, вызванные растущим образованием.
- Химиотерапия. Этот метод направлен на уменьшение размеров опухоли и удаление метастазов, что снижает риск рецидива заболевания.
- Лучевая терапия. Данный метод воздействует на опухоль на локальном уровне, что помогает подавить её рост.
- Гормональная терапия. Рекомендуется пациентам с раком молочной железы или простаты.
Основным недостатком химиотерапии и лучевой терапии является то, что в процессе лечения страдают не только атипичные, но и здоровые клетки. Это приводит к поражению кожи, слизистых оболочек и костного мозга, где формируются клетки крови. Поэтому у пациентов, проходящих химиотерапию, часто развиваются побочные эффекты, такие как анемия, проблемы с кишечником и выпадение волос. Даже с использованием современных препаратов и технологий врачи не могут полностью защитить здоровые клетки организма.
Иммунотерапия рака, отмеченная Нобелевской премией по медицине в 2018 году, стала настоящим прорывом в онкологии. Врачи отмечают, что этот подход изменил парадигму лечения рака, позволяя организму пациента активировать свои собственные защитные механизмы против опухолей. Специалисты подчеркивают, что иммунотерапия не только увеличивает выживаемость пациентов, но и улучшает качество жизни, снижая побочные эффекты по сравнению с традиционными методами лечения, такими как химиотерапия.
Медики также акцентируют внимание на важности индивидуального подхода к каждому пациенту, так как эффективность иммунотерапии может варьироваться в зависимости от типа рака и генетических особенностей. Врачи уверены, что дальнейшие исследования в этой области откроют новые горизонты в борьбе с онкологическими заболеваниями, и иммунотерапия станет стандартом лечения для многих пациентов.

Нобелевская премия по медицине 2018: в чём суть открытия
В Стокгольме 1 октября 2018 года была вручена Нобелевская премия в области медицины и физиологии. Награду получили два ученых: американец Джеймс Эллисон и японец Тасуку Хондзё. Их отметили за исследования в лечении раковых заболеваний.
Джеймс Эллисон (James P. Allison) — иммунолог, профессор Онкологического центра имени Монро Андерсона при Техасском университете, а также член Национальной академии наук США и Национальной медицинской академии США. На данный момент ему 70 лет.
Тасуку Хондзё (Tasuku Honjo) — иммунолог, профессор Киотского университета, где он работает с 1984 года. Он также является членом Национальной академии наук США, Германской академии естествоиспытателей «Леопольдина» и Японской академии наук.
Основное достижение этих ученых — новый подход к лечению рака. Их метод отличается от традиционных, таких как химиотерапия и лучевая терапия. Это иммунотерапия с использованием ингибиторов контрольных точек (Immune checkpoint therapy). Она снижает активность атипичных клеток и защищает иммунную систему от разрушения. Благодаря этому подходу иммунная система начинает активно атаковать раковые клетки.
Ученые выявили, что организм способен подавлять активность Т-лимфоцитов, отвечающих за уничтожение раковых опухолей. Если заблокировать механизмы, подавляющие Т-киллеры, лимфоциты «освобождаются» и начинают самостоятельно уничтожать опухолевые образования.
| Тип иммунотерапии | Механизм действия | Примеры применения (виды рака) |
|---|---|---|
| Проверка иммунных контрольных точек (ИКТ) | Блокирует белки, которые подавляют иммунный ответ опухолевых клеток, позволяя Т-клеткам атаковать раковые клетки. | Меланома, рак легких, рак почек, рак мочевого пузыря, лимфома Ходжкина |
| Адаптивный клеточный перенос (АКП) | Использует генетически модифицированные Т-клетки, которые распознают и уничтожают раковые клетки. | Лейкемия, лимфома, множественная миелома |
| Иммунотерапия с использованием онколитических вирусов | Использует вирусы, которые избирательно инфицируют и уничтожают раковые клетки, стимулируя при этом иммунный ответ. | Меланома, глиобластома, рак поджелудочной железы |
| Иммунные вакцины | Стимулируют иммунную систему для распознавания и уничтожения раковых клеток. | Меланома, рак простаты, рак легких |
| Моноклональные антитела | Нацелены на специфические белки на поверхности раковых клеток, вызывая их уничтожение или блокируя их рост. | Рак молочной железы, рак толстой кишки, рак легких, лимфома |
Принцип действия метода
Иммунная система человека состоит из множества клеток, которые делятся на активаторы (стимуляторы) и ингибиторы (тормозящие процессы). Гармония между этими группами поддерживает здоровье и позволяет иммунитету эффективно справляться с заболеваниями.
Т-лимфоциты, белые кровяные клетки, делятся на супрессоры, киллеры и хелперы. Каждый из этих типов выполняет уникальные функции. Т-хелперы распознают собственные и чуждые клетки. При обнаружении аномальных клеток они активируют иммунную систему, что приводит к притоку Т-киллеров и фагоцитов к месту проблемы, а также к увеличению выработки антител.
Т-киллеры, или цитотоксические лимфоциты, отвечают за защиту организма. Они реагируют на чуждые или аномальные клетки и белки, включая раковые опухоли.
Т-супрессоры контролируют иммунные процессы, предотвращая их чрезмерную активность и снижая риск аутоиммунных заболеваний.
При развитии опухоли в ней образуются белки с аномальной структурой, отличающиеся от привычных для организма. Т-клетки воспринимают их как чуждые.
Опухоль пытается обмануть иммунную систему, маскируясь: она удаляет с поверхности дефектные белки или уничтожает их. Кроме того, опухоли могут производить вещества, подавляющие активность иммунной системы. Чем активнее новообразование, тем меньше шансов у иммунитета справиться с ним.
Открытие Джеймса Эллисона стало важным шагом в онкологии. Он нашел способ разблокировки иммунной системы с помощью антител, нейтрализующих тормозящий белок. Эллисон сосредоточился на белке Т-лимфоцитов CTLA-4, который блокирует работу Т-киллеров. Он стремился создать антитело, связывающееся с этим белком и препятствующее его действию.
Эксперименты проводились на грызунах с раком, и ученый искал ответ на вопрос, поможет ли блокировка CTLA-4 активировать иммунитет для борьбы с опухолью.
Основное достижение Эллисона — гипотеза о «нездоровом» присутствии CTLA-4 на Т-киллерах. Этот белок образуется на иммунных клетках, чтобы опухоль могла их остановить. Каждая активная Т-киллер клетка имеет ингибирующую молекулу, конкурирующую с другими молекулами за сигнал от иммунной системы. Если на поверхности Т-киллера находится CTLA-4, он перехватывает сигналы от Т-хелперов, и иммунная система не направляет усилия на борьбу с раковыми клетками.
В 2010 году Эллисон провел испытания на людях с меланомой. У некоторых пациентов после иммунотерапии полностью исчезли остаточные проявления этого агрессивного рака.
Открытие доктора Тасуку Хондзё в 1992 году также стало значимым. Он обнаружил на поверхности Т-лимфоцитов молекулы белка PD-1, или «белка запрограммированной смерти клеток». Этот белок действует как тормоз, сдерживая рост опухолей и блокируя Т-киллеры.
Хондзё синтезировал антитела к PD-1, которые устраняли блокировку и повышали активность иммунной системы против раковых клеток.
Антитела против PD-1 показали эффективность в лечении меланомы, немелкоклеточного рака легких, почечной карциномы, лимфомы Ходжкина и других видов рака.
PD-1 и CTLA-4, а также их сигнальные пути были названы иммунными чекпоинтами. Ученые продемонстрировали, как уничтожение элементов, подавляющих иммунную систему, может помочь в борьбе с раковыми опухолями.
С момента открытия прошло более 15 лет, и за это время были разработаны препараты с ингибиторами иммунных чекпоинтов. В лечении рака используются один препарат, блокирующий CTLA-4, и пять препаратов, блокирующих PD-1. Разница в количестве объясняется тем, что многие опухоли имеют PD-1 на своей поверхности, что позволяет блокаторам PD-1 более целенаправленно воздействовать на опухоль, в то время как блокаторы CTLA-4 влияют только на активность Т-киллеров. Кроме того, использование блокаторов PD-1 связано с меньшим количеством осложнений.
Иммунотерапия рака стала настоящим прорывом в онкологии, и Нобелевская премия по медицине 2018 года, присуждённая Джеймсу Эллису и Тасуку Хондзё, подтвердила это. Люди с надеждой говорят о новых возможностях, которые открывает этот метод лечения. Многие пациенты отмечают, что иммунотерапия не только увеличивает шансы на выздоровление, но и улучшает качество жизни. Отзывы о лечении варьируются от восторженных до осторожных, так как не все пациенты реагируют на терапию одинаково. Тем не менее, исследования показывают, что иммунотерапия может активировать собственные защитные механизмы организма, что делает её более целенаправленной и менее токсичной по сравнению с традиционной химиотерапией. Обсуждения в медицинских кругах и среди пациентов подчеркивают важность дальнейших исследований и индивидуального подхода к каждому случаю.

Какие препараты используют для иммунотерапии рака?
Первое клиническое исследование препаратов было проведено в 2006 году на пациентах с онкологическими заболеваниями. В этом испытании участвовал Ниволумаб, блокатор PD-1. Однако его одобрение для лечения онкологических больных произошло только в 2014 году. В это же время завершились клинические испытания Пембролизумаба, выпускаемого компанией Merck.
В России зарегистрированы следующие препараты:
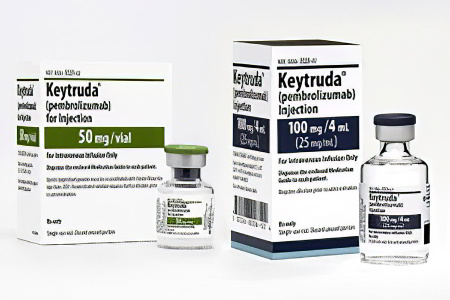
- Пембролизумаб (Кейтруда). Применяется для терапии рака легких и меланомы. Его основное преимущество — высокая эффективность в лечении метастатических опухолей. Стоимость одного флакона составляет 3290 евро.
- Опдиво (Ниволумаб). Аналог Кейтруды с более низкой ценой. Успешно используется для лечения рака почек и меланомы. Цена упаковки 40 мг — 915 долларов, 100 мг — 2200 долларов. Стоимость может варьироваться в зависимости от поставщика.
- Ервой (Ипилимумаб). Назначается взрослым и детям старше 12 лет в дозировке 3 мг/кг. Для полного курса требуется 4 дозы, вводимые раз в 21 день в течение 1 часа 30 минут. Стоимость флакона 50 мг/10 мл составляет 4200-4500 евро, а 200 мг/40 мл — 15 000 евро.
- Тецентрик (атезолизумаб). Используется для лечения уротелиального и немелкоклеточного рака легких. Цены зависят от посредников и места покупки. В США один флакон стоит от 6500 до 8000 долларов.
Эти препараты могут применяться как самостоятельно, так и в различных комбинациях. Лечение показано пациентам с неоперабельной меланомой с метастазами, лимфомой Ходжкина, рецидивирующим и метастатическим плоскоклеточным раком головы и шеи, а также неоперабельным раком мочевого пузыря.
В России также производятся иммунологические препараты для лечения раковых заболеваний. Практическое применение чек-пойнт терапии только начинается. Ожидается, что в ближайшие годы количество препаратов этой группы значительно увеличится, что позволит лечить и другие виды рака. Стоимость терапии станет более доступной, так как большая часть затрат будет покрыта.
Оценка рисков метода
Иммунотерапия не является универсальным решением для борьбы с раком. Применение этих медикаментов не гарантирует 100% выздоровления пациента. Эти препараты неэффективны против всех типов раковых образований, и важную роль играет генетический профиль конкретного человека.
Лечение с помощью иммунологических средств связано с риском побочных эффектов, которые чаще всего проявляются в виде аутоиммунных реакций. Активные компоненты воздействуют на иммунную систему, что может привести к её чрезмерной активности и аутоиммунным воспалениям внутренних органов.
Еще одним ограничением этих препаратов является то, что они предназначены только для взрослых. Дети не получают такие назначения.
Иммунологические препараты строго противопоказаны беременным женщинам, так как это может привести к гибели плода. Это связано с тем, что развивающийся в утробе ребенок использует те же механизмы уклонения от иммунной системы, что и раковые клетки.
У некоторых пациентов эти лекарства могут оказаться неэффективными, поскольку опухолевые клетки способны скрываться от атак активированной иммунной системы.

Метод генной иммунотерапии рака CAR-T
CAT-T представляет собой передовой подход к лечению онкологических заболеваний, который был представлен на конференции Американского общества клинической онкологии (ASCO) в докладе «Достижения клинической онкологии 2018».
Эта терапия основана на способности Т-лимфоцитов взаимодействовать с химерными антигенными рецепторами. Сокращенно метод известен как CAR-T (chimeric antigen receptor T-cell).
Идея создания химерных антигенных рецепторов CAR впервые пришла в голову Зелигу Эшхару из Института наук имени Вейцмана в израильском Реховоте. Как химик и иммунолог, он стал первопроходцем в получении трансгенных Т-лимфоцитов с CAR в своей лаборатории.
Тем не менее, клинические испытания этой новаторской методики лечения рака завершились только к 2017 году. В ходе исследований были разработаны и получили одобрение два препарата: Kymriah и Yescarta.
Если рассматривать CAR-T в более широком контексте, его можно отнести к нескольким категориям лечения: генетической, клеточной и иммунотерапии.
В чём суть такого лечения?
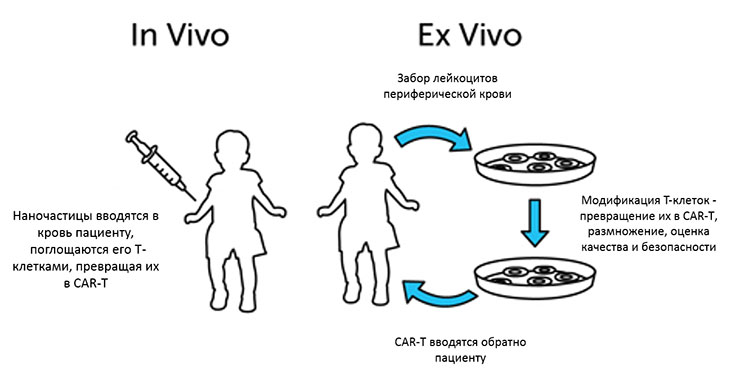
Технология CAR позволяет перепрограммировать иммунные клетки пациента вне его организма. Исследователи разрабатывают CAR Т-клетки, которые способны обнаруживать и уничтожать раковые опухоли. Эти клетки применяются в адоптивной иммунотерапии, одной из форм лечения рака.
CAR T-клетки получают с помощью технологии ex vivo, что подразумевает использование крови пациента. Из неё выделяются Т-лимфоциты, отвечающие за защиту организма от раковых и других аномальных клеток. Затем в хромосому Т-клетки вводится ДНК, кодирующая CAR. Эти изменения позволяют Т-лимфоцитам производить на своей поверхности химерные рецепторы, которые помогают находить маркеры, расположенные на раковых опухолях. После обнаружения таких маркеров иммунная система получает сигнал к атаке. CAR T-клетки размножаются вне организма, а затем вводятся в кровь пациента.
Если генно модифицированная клетка сталкивается со здоровой клеткой, она не вызывает реакции. Однако при встрече с раковой клеткой химерный антигенный рецептор распознает маркер, на который он был запрограммирован. Т-лимфоцит атакует опухолевую клетку и уничтожает её, после чего начинает активно делиться, что позволяет полностью избавиться от рака.
Т-лимфоциты, вводимые в организм пациента, способны увеличивать своё количество. Поэтому полученный препарат считается «живым». В начале в кровь вводится лишь небольшое количество изменённых Т-клеток. При обнаружении раковой опухоли эти клетки начинают активно делиться, образуя целую армию.
CAR-лимфоциты продолжают свою работу до тех пор, пока не будут уничтожены все опухолевые клетки. Когда раковые клетки в организме исчезнут, большинство CAR T-клеток погибнет, но небольшой резерв останется в костном мозге. В случае рецидива болезни они снова активируются и начнут делиться для борьбы с раком.
Этот метод эффективен для лечения таких видов опухолей, как:
- Агрессивная В-клеточная лимфома.
- Острая лимфобластная лейкемия у детей и взрослых.
- В-клеточная крупноклеточная лимфома, включая диффузную лимфому.
В настоящее время учёные продолжают исследования, направленные на применение метода CAR для борьбы с другими типами опухолей.
Схема проведения CAR T-клеточной терапии
CART — это современный метод лечения рака, разработанный в США. Ведущие онкологические центры мира успешно применяют эту терапию, которая считается безопасной и эффективной.
Сначала пациент проходит ряд диагностических обследований. Если противопоказания к CART отсутствуют, назначается лечение, которое длится несколько недель. В этот период пациент может находиться как в стационаре, так и дома.
- Первый этап: забор крови. Врачи с помощью специализированного оборудования проводят забор крови у пациента. Затем кровь разделяется, и из неё выделяются лейкоциты. Этот процесс называется лейкаферезом и занимает около 5 часов.
- Второй этап: обработка Т-лимфоцитов. В лаборатории происходит генетическая модификация клеток крови. Ученые активируют экспрессию химерных антигенных рецепторов, нацеленных на опухолевые клетки. В это время пациент может находиться вне больницы.
- Третий этап: химиотерапия перед реализацией CART. Перед введением обработанных Т-лимфоцитов пациенту необходимо снова сдать анализы. Иногда может возникнуть ситуация, когда дальнейшее лечение становится невозможным. Если состояние остается стабильным, назначается краткосрочная химиотерапия, и анализы нужно сдавать ежедневно.
- Четвёртый этап: введение Т-лимфоцитов. Инфузия занимает около получаса, но в некоторых случаях процедура может затянуться до 1 часа 30 минут. После этого пациент должен оставаться под наблюдением врачей еще около 5-6 часов. Если есть риск побочных эффектов, пациента могут оставить в больнице на несколько дней.
FDA требует, чтобы наблюдение за пациентами, прошедшими CART, продолжалось не менее 15 лет.
Зарегистрированные препараты для CAR-T
В 2017 году были одобрены два препарата для CART, утвержденные Управлением по контролю за продуктами и лекарствами США (FDA) на основе клинических испытаний.
Kymriah (тизагенлеклейкел / tisagenlecleucel). Это первый в своем роде препарат, разработанный компанией Novartis, который начали применять с 30 августа 2017 года. Он предназначен для детей и взрослых до 25 лет, страдающих от рака крови на последних стадиях.
Kymriah назначается пациентам, у которых не удалось достичь положительных результатов лечения традиционными методами или с помощью трансплантации костного мозга. Рецидив заболевания не является препятствием для начала терапии.
Однако высокая стоимость Kymriah ограничивает его массовое использование. Создание генетически модифицированных Т-клеток и их введение пациенту обойдется в 475 000 долларов, не включая расходы на медицинские услуги.
Несмотря на доступность препарата, ученые продолжают исследовать его характеристики. В настоящее время Kymriah находится на этапе постмаркетинговых наблюдательных исследований.
Yescarta (аксикабтагн цилолейкел / axicabtagene ciloeucel). Это второй препарат для CAR T-клеточной терапии, который начали применять с 18 октября 2017 года. Он производится компанией Kite Pharma Inc.
Yescarta используется для лечения взрослых с В-клеточной крупноклеточной лимфомой, если болезнь не реагирует на другие виды терапии и рецидивирует. Единственным противопоказанием является первичное поражение лимфомой головного или спинного мозга.
Стоимость Yescarta также высока и составляет 373 000 долларов. Производители активно ищут способы снизить затраты на его производство, чтобы сделать препарат более доступным для большего числа пациентов.
Побочное действие CAR T-терапии
Метод CAR T-терапии позволяет клеткам иммунной системы распознавать и уничтожать опухоли. Однако активация иммунной системы может вызвать серьезные последствия. У многих пациентов возникают тяжелые побочные эффекты.
Для проведения CAR T-терапии медицинские учреждения должны иметь специальную лицензию. Врачи обязаны информировать пациентов о возможных последствиях лечения. Важно тщательно оценить все потенциальные риски.
Побочные эффекты могут проявляться в период с 1 по 22 день после введения модифицированных клеток. К ним относятся:
- Ослабление иммунной системы и резкое снижение уровня лейкоцитов в крови, что может привести к инфекциям.
- Анемия и гипотония.
- Острая почечная недостаточность, которая встречается довольно редко.
- Неврологические расстройства, включая возможный отек головного мозга.
Наиболее распространенной побочной реакцией является цитокиновый шторм, который наблюдается у 75% пациентов. Цитокины — это белки, регулирующие иммунные реакции. После взаимодействия измененных Т-клеток с опухолью в кровь выбрасывается большое количество цитокинов, что приводит к повышению температуры, рвоте, диарее и усилению слабости. Если состояние не удается стабилизировать, риск летального исхода возрастает.
Чтобы предотвратить массовый выброс цитокинов, рекомендуется использовать блокаторы. Для снижения риска цитокинового шторма пациентам назначают препарат Актемра (Tocilizumab) или традиционные нестероидные противовоспалительные средства, такие как Диклофенак.
Какие успехи были в генной иммунотерапии рака CAR-T?
30 ноября были подведены результаты годового применения генной терапии. Заказчиком выступило Управление по контролю за продуктами и лекарствами США, которое выдало разрешение на использование этих медицинских препаратов. Итоги исследования опубликованы в журнале New England Journal of Medicine. Лечение прошли 93 пациента.
Выяснилось, что 37 из них полностью избавились от заболевания. Еще 11 пациентов отметили значительное улучшение состояния, но полного излечения от рака достичь не удалось. Таким образом, ученые пришли к выводу, что эффективность методики составляет 50%.
Ситуация в России
В России технология CART впервые была внедрена в Центре детской гематологии имени Дмитрия Рогачева (НМИЦ ДГОИ). Главным руководителем долгосрочных исследований является доктор медицинских наук Михаил Масчан. На начальном этапе проект получил поддержку от фонда «Подари жизнь». Реализация метода в этом медицинском учреждении стала возможной благодаря щедрым пожертвованиям топ-менеджеров компании Роснефть и фонду «Врачи, инновации, наука – детям».
В 2018 году лечение прошли 20 детей и молодых людей, страдающих от острого лимфобластного лейкоза и В-клеточных лимфом. Другие методы терапии не дали желаемых результатов, и единственной надеждой оставался CART.
В России ежегодно в таком лечении нуждаются десятки детей и сотни взрослых. Михаил Масчан.
Над чем ещё работают учёные
В 2018 году были сделаны значительные шаги в лечении онкологических заболеваний. В 2019 году ожидаются новые достижения в этой области.
Иммунотерапия рака
Помимо терапии с использованием CFR T-клеток, разрабатывается метод, основанный на опухоль-инфильтрирующих лимфоцитах (TIL). Этот подход уже помог 49-летней женщине избавиться от метастатического рака молочной железы. Однако масштабные клинические испытания пока не проводились.
Жидкая биопсия: точный и простой анализ на рак
Жидкая биопсия позволяет диагностировать рак с помощью анализа крови. Новые методы помогают отслеживать лечение и предсказывать возможные рецидивы.
В последние годы на рынке появилось множество тестов от различных производителей, которые заявляют о высокой эффективности своих продуктов. Однако в 2018 году Американское общество клинической онкологии (ASCO) сообщило, что большинство из этих тестов не подходят для диагностики и мониторинга заболеваний. Это связано с недостаточной доказанной эффективностью таких методов.
Снижение побочных эффектов лечения
В предыдущие десятилетия основное внимание уделялось поиску эффективных методов борьбы с раком. Однако в 2018 году акцент сместился на исследования, направленные на минимизацию побочных эффектов лечения. Это касается, прежде всего, проблем с мужским бесплодием и нарушениями полового созревания у девочек, перенесших химиотерапию. Также значительное внимание уделяется предотвращению косметических дефектов, возникающих после операций, таких как удаление молочной железы и других вмешательств.
Онкозаболевания и микрофлора организма
Недавние исследования показывают, что микрофлора может предсказывать реакцию организма на химиотерапию.
Статья в журнале Nature Communications сообщает, что некоторые бактерии в человеческом микробиоме влияют на иммунную систему и способствуют развитию множественной меланомы — формы рака крови, которая трудно поддается лечению. Уничтожение этих бактерий может изменить подход к лечению рака.
Органоиды
Органоиды — это небольшие органы, созданные в лаборатории из клеток человека, которые могут революционизировать онкологию. Информация о их разработках появилась в СМИ в 2017 году. С помощью органоидов можно тестировать различные медикаменты и прогнозировать реакцию организма пациента на лечение.
Эти технологии успешно внедрены в крупных научных учреждениях. Органоиды поставляются в исследовательские лаборатории, что значительно улучшает результаты скрининга противоопухолевых препаратов.
Тем не менее, органоиды не идеальны для тестирования лекарств. Они не получают кровоснабжения и не связаны с другими системами организма. Ученые продолжают работать над улучшением органоидов и методов их создания, и в будущем их применение станет более широким.
Видео: профессор Дэниел Чен (США) на конференции «Иммуноонкология» (6 апреля 2018 г., Москва) «Иммунотерапия рака: от теоретических основ к прорывам в лечении»:
Вопрос-ответ
Кто получил Нобелевскую премию в 2018 году по медицине?
Ученые Джеймс Эллисон из США и Тасуку Хондзё из Японии изобрели ингибиторы контрольных точек – препараты, активирующие иммунную систему против раковых клеток. Открытие иммунологов стало настоящим прорывом в борьбе с онкологией. Новый подход к лечению болезни стал известен как Immune checkpoint therapy.
Кто получил Нобелевскую премию по иммунотерапии в 2018 году?
Джеймс П. Эллисон и Тасуку Хондзё были удостоены Нобелевской премии по физиологии и медицине за разработку революционного метода лечения рака: блокады иммунных контрольных точек. Это поистине заслуженная награда для Эллисона и Хондзё.
Нобелевская премия в каком направлении не вручалась в 2018 году из за скандала?
Шведская академия решила отказаться от вручения Нобелевской премии по литературе в этом году. Это связано со скандалом, в центре которого оказался муж одного из членов академии, фотограф Жан-Клод Арно, которого обвинили в сексуальных домогательствах.
Советы
СОВЕТ №1
Изучите основы иммунотерапии. Понимание принципов работы иммунотерапии поможет вам лучше осознать, как она влияет на лечение рака и какие преимущества она может предоставить по сравнению с традиционными методами.
СОВЕТ №2
Обсудите с врачом возможности иммунотерапии. Если вы или ваши близкие столкнулись с диагнозом рака, важно обсудить с врачом, подходит ли иммунотерапия для вашего случая и какие исследования или клинические испытания могут быть доступны.
СОВЕТ №3
Следите за новыми исследованиями и достижениями в области иммунотерапии. Научные исследования в этой области активно развиваются, и новые данные могут существенно изменить подходы к лечению рака. Подписывайтесь на медицинские журналы и новостные рассылки.
СОВЕТ №4
Поддерживайте здоровый образ жизни. Правильное питание, физическая активность и управление стрессом могут помочь вашему организму лучше реагировать на лечение и поддерживать иммунную систему в оптимальном состоянии.